तत्वों और उनके वर्गीकरण का महत्व:
रसायन शास्त्र में तत्व वह बुनियादी इकाई हैं जिनसे पदार्थ बनते हैं। हर तत्व में अद्वितीय गुण होते हैं जो इसे अन्य तत्वों से अलग बनाते हैं। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अध्ययन के अंतर्गत तत्वों का क्रमबद्ध वर्गीकरण इसीलिए महत्वपूर्ण है ताकि हम इन गुणों को आसानी से समझ सकें और विभिन्न तत्वों के बीच संबंध स्थापित कर सकें। बढ़ते तत्वों की संख्या के कारण, इनका वर्गीकरण रसायन शास्त्र का एक प्रमुख हिस्सा बन गया है, जिससे छात्रों और वैज्ञानिकों को इनके गुणधर्मों का अध्ययन करना आसान हो गया है।
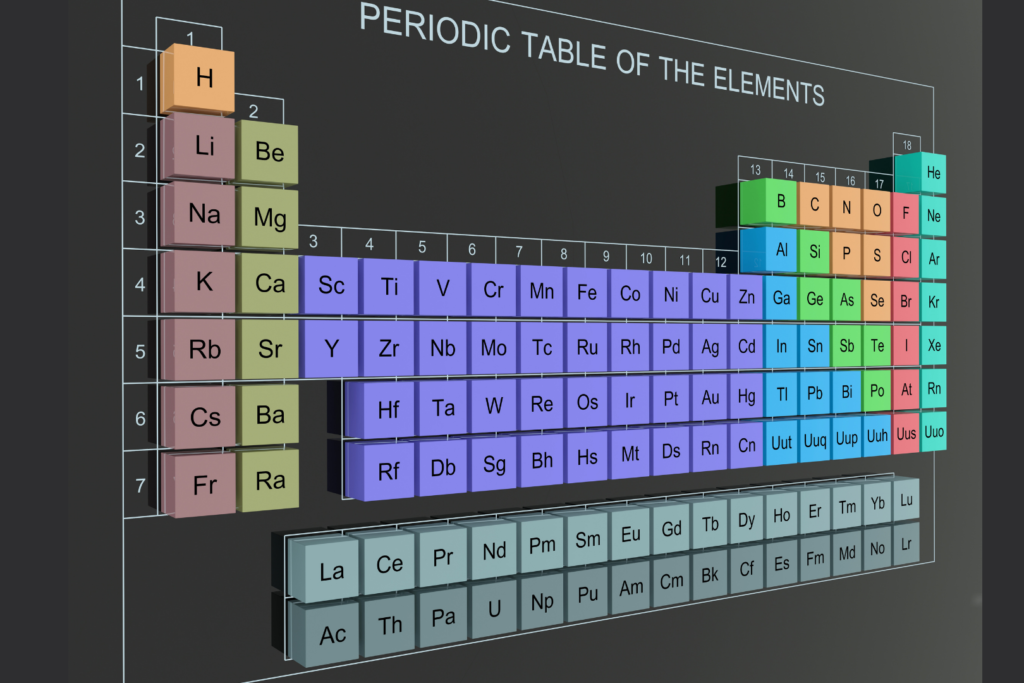
क्यों आवश्यक है तत्वों को क्रमबद्ध करना?
जैसे-जैसे नए तत्वों की खोज होती गई, उन्हें समझने और उनका वर्गीकरण करने की चुनौती बढ़ती गई। “तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) ” के माध्यम से, छात्रों को इन तत्वों की पहचान और उनके गुणों का सही आकलन करने में मदद मिलती है।
क्या आप जानते हैं न्यूटन के पहले नियम (Newton’s First Law In Hindi) के बारे में? जानें इसके आसान उदाहरण और कैसे यह हमारे रोजमर्रा के जीवन में लागू होता है, अभी पढ़ें!
ऐतिहासिक पृष्ठभूमि
प्राचीन समय में तत्वों को उनकी विशेषताओं के आधार पर समझा जाता था, लेकिन स्पष्ट वर्गीकरण का अभाव था। जैसे-जैसे वैज्ञानिक तत्वों के गुणों पर अनुसंधान करते गए, उन्होंने तत्वों को व्यवस्थित रूप से वर्गीकृत करने का प्रयास किया। इस वर्गीकरण ने रसायन शास्त्र को एक नई दिशा दी और वैज्ञानिकों के लिए तत्वों के गुणधर्मों का अध्ययन करना आसान हो गया।
प्रारंभिक वर्गीकरण के प्रयास (Early Attempts at Classification)
डॉबेरिनर की ट्रायड्स (Dobereiner’s Triads)
परिचय: 1829 में जर्मन रसायनशास्त्री जोहान वुल्फगैंग डॉबेरिनर ने तत्वों को वर्गीकृत करने का एक प्रयास किया, जिसे “डॉबेरिनर की ट्रायड्स” कहा गया। उनके इस सिद्धांत के अनुसार, कुछ तत्वों को तीन-तीन के समूहों में वर्गीकृत किया गया, जिन्हें ट्रायड्स (त्रिक) कहा गया। इस सिद्धांत के पीछे तर्क यह था कि एक समूह में शामिल तत्वों में कुछ समान गुणधर्म होते हैं और इस तरह का वर्गीकरण करना उनके अध्ययन को आसान बना सकता है।
ट्रायड्स का सिद्धांत:डॉबेरिनर ने यह सुझाव दिया कि तीन तत्वों के किसी भी समूह में मध्य तत्व का परमाणु भार, पहले और तीसरे तत्व के परमाणु भार के औसत के बराबर होता है। इसे समझाने के लिए उन्होंने कुछ तत्वों के समूह बनाए, जिनमें एक विशेष पैटर्न देखा जा सकता था। उदाहरण के लिए:

1. लीथियम (Li), सोडियम (Na), और पोटैशियम (K): इस समूह में:
- लीथियम का परमाणु भार लगभग 7 है।
- पोटैशियम का परमाणु भार लगभग 39 है।
- दोनों का औसत 7+392=23\frac{7 + 39}{2} = 2327+39=23 होता है, जो सोडियम के परमाणु भार के लगभग बराबर है।
2. कैल्शियम (Ca), स्ट्रॉन्शियम (Sr), और बेरियम (Ba):
- कैल्शियम का परमाणु भार लगभग 40 है।
- बेरियम का परमाणु भार लगभग 137 है।
- दोनों का औसत 40+1372=88.5\frac{40 + 137}{2} = 88.5240+137=88.5, जो स्ट्रॉन्शियम के परमाणु भार के लगभग समान है।
सिद्धांत की सीमाएँ: हालाँकि डॉबेरिनर की ट्रायड्स ने तत्वों के वर्गीकरण का एक प्रारंभिक आधार दिया, लेकिन इसके कुछ महत्वपूर्ण सीमाएँ थीं:
- यह केवल कुछ ही तत्वों पर लागू किया जा सकता था।
- इस नियम का पालन सभी तत्वों के लिए नहीं किया जा सकता था, जिससे यह एक सीमित और असंगत वर्गीकरण पद्धति बन गया।
प्रभाव: डॉबेरिनर का यह सिद्धांत तत्वों के व्यवस्थित अध्ययन की दिशा में एक पहला प्रयास था, जिसने आगे चलकर तत्वों के बेहतर वर्गीकरण की संभावनाओं को जन्म दिया। हालाँकि, इसकी सीमाओं के कारण इसे अधिक व्यापक स्वीकार्यता नहीं मिली, लेकिन यह रसायनशास्त्र में तत्वों की समझ को बेहतर बनाने में मददगार साबित हुआ।
न्यूलैंड्स का अष्टक नियम (Newlands’ Law of Octaves)
परिचय: 1864 में अंग्रेज़ रसायनशास्त्री जॉन न्यूलैंड्स ने तत्वों का वर्गीकरण करने का एक नया प्रयास किया। उन्होंने “अष्टक नियम” (Law of Octaves) प्रस्तुत किया, जो संगीत के आठ स्वरों (सप्तक) पर आधारित था। उनके अनुसार, जब तत्वों को उनके बढ़ते हुए परमाणु भार के क्रम में रखा जाता है, तो हर आठवें तत्व का गुणधर्म पहले तत्व के समान होता है।
अष्टक नियम का सिद्धांत: न्यूलैंड्स ने पाया कि कुछ तत्वों में यह पैटर्न दिखाई देता है कि यदि उन्हें बढ़ते परमाणु भार के क्रम में रखते हैं, तो हर आठवाँ तत्व पहले तत्व के समान गुणधर्म दिखाता है। इसे समझने के लिए उदाहरण स्वरूप:
- हाइड्रोजन (H) से शुरू करके जब तत्वों को एक क्रम में रखते हैं, तो आठवें तत्व फ्लोरीन (F) के गुणधर्म हाइड्रोजन से मिलते हैं।
- इसी प्रकार सोडियम (Na) और पोटैशियम (K) के गुणधर्म भी एक समान पाए गए।
नियम की सीमाएँ: हालाँकि न्यूलैंड्स का अष्टक नियम कुछ तत्वों के लिए प्रभावी था, लेकिन इसमें भी कई सीमाएँ थीं:

- यह नियम केवल हल्के तत्वों (कैल्शियम तक) के लिए ही काम करता था और भारी तत्वों (जैसे कि ट्रांजिशन धातुएं) पर लागू नहीं हो पाता था।
- जैसे-जैसे नए तत्वों की खोज हुई, इस नियम का महत्व घटने लगा, क्योंकि यह सभी तत्वों पर लागू नहीं किया जा सकता था।
- न्यूलैंड्स ने इस नियम के अनुसार आवर्तकता का अध्ययन तो किया, लेकिन उसके वैज्ञानिक आधार को पूर्ण रूप से नहीं समझा पाए, जिससे वैज्ञानिक समुदाय में इसे व्यापक स्वीकृति नहीं मिल सकी।
न्यूलैंड्स के अष्टक नियम का महत्व: न्यूलैंड्स का अष्टक नियम महत्वपूर्ण था क्योंकि यह तत्वों के क्रमबद्ध वर्गीकरण की दिशा में एक महत्वपूर्ण कदम था। यह पहला प्रयास था जिसने तत्वों की आवर्तकता का सिद्धांत प्रस्तुत किया। यद्यपि यह नियम पूर्ण रूप से सही नहीं था, फिर भी इसने मेंडलीव और बाद के वैज्ञानिकों को तत्वों की आधुनिक आवर्त सारणी बनाने के लिए प्रेरित किया।
मेंडलीव की आवर्त सारणी (Mendeleev’s Periodic Table)
परिचय: रूसी रसायनशास्त्री दिमित्री इवानोविच मेंडलीव ने 1869 में तत्वों की पहली व्यवस्थित आवर्त सारणी (Periodic Table) प्रस्तुत की। मेंडलीव का योगदान इस दृष्टि से अनोखा था कि उन्होंने तत्वों को उनके बढ़ते परमाणु भार (Atomic Mass) के आधार पर क्रमबद्ध किया। इसके साथ ही, उन्होंने इस आवर्त सारणी में उन तत्वों के लिए भी स्थान छोड़ा जिनकी खोज उस समय तक नहीं हुई थी, लेकिन जिनके गुणधर्मों का अनुमान वे उनके स्थान के आधार पर कर पाए थे।
अज्ञात तत्वों की भविष्यवाणी: मेंडलीव ने अपने आवर्त सारणी में कुछ गैप्स (खाली स्थान) छोड़े, यह मानते हुए कि इन स्थानों में भविष्य में खोजे जाने वाले तत्वों का स्थान होगा। ये गैप्स उनके उस दृष्टिकोण को दर्शाते हैं कि तत्वों के गुणधर्म उनके परमाणु भार के साथ आवर्तक (periodic) रूप में दोहराते हैं।
उदाहरण: उन्होंने गैलियम और जर्मेनियम जैसे तत्वों की खोज से पहले ही उनके गुणधर्मों और परमाणु भार का अनुमान लगाया, और बाद में खोजे गए तत्वों ने उनके पूर्वानुमानों की पुष्टि की। उन्होंने गैलियम को “eka-aluminium” और जर्मेनियम को “eka-silicon” के रूप में नामांकित किया, जिनके गुणधर्मों का अनुमान पहले ही कर लिया गया था।

क्या आप Physics के बारे में और गहराई से जानना चाहते हैं? तो पढ़ें हमारे Best 100 Physics GK Question In Hindi Quiz और अपनी ज्ञान की परीक्षा लें!
महत्वपूर्ण विशेषताएँ:
मेंडलीव का आवर्त नियम (Mendeleev’s Periodic Law)
आवर्त नियम का सार: मेंडलीव (Mendeleev’s Periodic Law) ने कहा कि “तत्वों के गुणधर्म उनके परमाणु भार के आवर्त होते हैं।” इसका अर्थ यह है कि जब तत्वों को उनके बढ़ते हुए परमाणु भार के आधार पर व्यवस्थित किया जाता है, तो प्रत्येक आठवें तत्व के गुणधर्म पहले तत्व के समान होते हैं। इसी आधार पर उन्होंने समान गुणधर्मों वाले तत्वों को एक ही कॉलम में रखा।
उदाहरण: उन्होंने तत्वों को इस प्रकार क्रमबद्ध किया कि समान गुणधर्मों वाले तत्व एक ही समूह (Group) में आ गए। जैसे:
- क्षार धातुएं (Alkali Metals): लीथियम (Li), सोडियम (Na), पोटैशियम (K), जो सभी समूह 1 में आते हैं और समान रासायनिक गुणधर्म दर्शाते हैं।
- हैलोजन (Halogens): फ्लोरीन (F), क्लोरीन (Cl), ब्रोमीन (Br), जो सभी समूह 17 में हैं और समान गुणधर्म प्रदर्शित करते हैं।
आवर्त सारणी की संरचना: मेंडलीव ने अपनी सारणी को पंक्तियों और कॉलमों में विभाजित किया। पंक्तियों को “आवर्त” (Periods) और कॉलमों को “समूह” (Groups) कहा गया।
- आवर्त (Periods): पंक्तियाँ, जिनमें परमाणु भार के आधार पर तत्व क्रमबद्ध होते हैं।
- समूह (Groups): कॉलम, जिनमें समान रासायनिक गुणधर्मों वाले तत्व एक साथ रखे जाते हैं।

मेंडलीव की सारणी की सीमाएँ (Limitations of Mendeleev’s Table)
1. कुछ तत्वों का गलत स्थान
विवरण: मेंडलीव ने तत्वों को उनके परमाणु भार के आधार पर व्यवस्थित किया था। लेकिन जब उन्होंने तत्वों को इस सिद्धांत के अनुसार क्रमबद्ध किया, तो कुछ तत्वों के गुणधर्म उनके सही स्थान से मेल नहीं खाते थे। इस समस्या का सामना विशेष रूप से उन तत्वों में हुआ जो अपने क्रम में अगले या पिछले तत्वों से गुणधर्मों में भिन्न थे।
उदाहरण:
आर्गन (Ar) और पोटैशियम (K): आर्गन और पोटैशियम का स्थान निर्धारण इस सिद्धांत के अनुसार मुश्किल था। परमाणु भार के अनुसार, पोटैशियम का स्थान आर्गन से पहले होना चाहिए था, क्योंकि पोटैशियम का परमाणु भार 39.1 और आर्गन का 39.9 था। लेकिन गुणधर्मों के आधार पर, मेंडलीव ने पोटैशियम को आर्गन के बाद रखा ताकि उनका गुणधर्म संरचना से मेल खा सके।
इससे यह स्पष्ट हुआ कि परमाणु भार ही सही क्रम में तत्वों के गुणधर्मों की सटीक भविष्यवाणी करने के लिए पर्याप्त नहीं है, जिसके कारण बाद में परमाणु संख्या पर आधारित आवर्त सारणी विकसित की गई।
2. हाइड्रोजन की स्थिति
विवरण: हाइड्रोजन के गुणधर्म इस प्रकार के हैं कि यह क्षार धातुओं (Alkali Metals) और हैलोजन (Halogens) दोनों से कुछ समानताएं प्रदर्शित करता है। इसकी रासायनिक क्रियाएँ इस तत्व को एक अद्वितीय स्थान पर रखती हैं, और इसका व्यवहार दो भिन्न समूहों के तत्वों से मेल खाता है, जिसके कारण इसे एक निश्चित समूह में रखना मुश्किल हो गया।
विशेषताएँ और समस्याएँ:
- क्षार धातुओं से समानता: हाइड्रोजन और क्षार धातुओं (जैसे लिथियम, सोडियम) में इलेक्ट्रॉनिक विन्यास की समानता है। हाइड्रोजन भी क्षार धातुओं की तरह एक इलेक्ट्रॉन देकर धनायन (H⁺) बनाता है।
- हैलोजन से समानता: हाइड्रोजन की एक और विशेषता यह है कि यह हैलोजन तत्वों (जैसे क्लोरीन, फ्लोरीन) की तरह एक इलेक्ट्रॉन ग्रहण करके अनायन (H⁻) बनाता है।
इस दोहरे स्वभाव के कारण इसे एक निश्चित समूह में रखना संभव नहीं हो पाया, और इस समस्या का हल मेंडलीव की आवर्त सारणी में नहीं मिल सका। हाइड्रोजन की अनिश्चित स्थिति आज भी एक चुनौती बनी हुई है, और आधुनिक आवर्त सारणी में इसे शीर्ष पर स्वतंत्र रूप से रखा गया है।

3. आइसोटोप्स के लिए स्पष्ट नियम नहीं
विवरण: मेंडलीव की सारणी में तत्वों को उनके परमाणु भार के आधार पर रखा गया था, लेकिन आइसोटोप्स की खोज के बाद यह नियम सटीक नहीं बैठ सका। आइसोटोप्स ऐसे तत्व होते हैं जिनका परमाणु क्रमांक समान होता है, लेकिन उनका परमाणु भार भिन्न होता है।
उदाहरण:
- कार्बन: कार्बन का एक प्रमुख आइसोटोप कार्बन-12 है, जबकि दूसरा आइसोटोप कार्बन-14 है। इन दोनों का परमाणु क्रमांक समान (6) है लेकिन परमाणु भार अलग-अलग हैं।
- प्रभाव: चूंकि मेंडलीव की आवर्त सारणी परमाणु भार पर आधारित थी, आइसोटोप्स के आविर्भाव के साथ उसकी संरचना पर सवाल उठने लगे।
आइसोटोप्स की खोज से यह स्पष्ट हो गया कि परमाणु क्रमांक तत्वों के गुणधर्मों को समझने के लिए अधिक उपयुक्त है, न कि परमाणु भार। बाद में जब मॉस्ले ने परमाणु क्रमांक के महत्व को पहचाना, तो आवर्त सारणी को संशोधित कर इसे एक नए और अधिक वैज्ञानिक आधार पर बनाया गया।
4. तत्वों का अनुक्रम
विवरण: कुछ भारी तत्वों के मामले में उनके गुणधर्मों के आधार पर उन्हें आवर्त सारणी में रखने में कठिनाई आई। मेंडलीव की सारणी में तत्वों को उनके परमाणु भार के आधार पर रखा गया था, लेकिन जैसे-जैसे अधिक भारी तत्वों की खोज हुई, यह स्पष्ट हुआ कि उनका सही अनुक्रम स्थापित करने के लिए केवल परमाणु भार पर्याप्त नहीं है।
समस्या का समाधान: बाद में जब परमाणु क्रमांक का सिद्धांत आया, तब वैज्ञानिकों ने पाया कि तत्वों के गुणधर्म परमाणु क्रमांक के आधार पर अधिक सटीकता से निर्धारित किए जा सकते हैं। परमाणु क्रमांक पर आधारित संशोधित आवर्त सारणी ने इस समस्या को हल कर दिया। अब सभी तत्व अपने परमाणु क्रमांक के अनुसार व्यवस्थित किए जाते हैं, जिससे भारी तत्वों का अनुक्रम बिना किसी समस्या के तय किया जा सकता है।

आधुनिक आवर्त सारणी (Modern Periodic Table)
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अंतर्गत आधुनिक आवर्त सारणी का महत्व काफी बढ़ गया है। हेनरी मॉसले द्वारा दिए गए आधुनिक आवर्त नियम के अनुसार, तत्वों के गुणधर्म उनके परमाणु क्रमांक के अनुसार बदलते हैं न कि उनके परमाणु भार के अनुसार। यह सिद्धांत अधिक सटीक और वैज्ञानिक रूप से उपयुक्त साबित हुआ। इस परिवर्तन ने आवर्त सारणी को एक नई दिशा दी, जिससे तत्वों का वर्गीकरण परमाणु क्रमांक के आधार पर और अधिक सटीक तरीके से संभव हो सका।
आधुनिक आवर्त नियम
हेनरी मॉसले ने अपने शोध में बताया कि परमाणु क्रमांक ही वह आधार है जिसके अनुसार तत्वों के गुणधर्मों में आवर्तता देखी जा सकती है। यह आवर्त नियम, जो तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में समझाया गया है, परमाणु क्रमांक के आधार पर तत्वों की व्यवस्थितता को संभव बनाता है। इस नियम से मेंडलीव की सारणी में पाई जाने वाली कमियाँ दूर हो गईं और अब तत्वों का स्थान उनके परमाणु क्रमांक के अनुसार अधिक सटीकता से निर्धारित किया जा सकता है।
आधुनिक आवर्त सारणी की संरचना
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अनुसार, आधुनिक आवर्त सारणी में तत्वों को उनके परमाणु क्रमांक के आधार पर क्रमबद्ध किया गया है। यह क्रमबद्धता समूह (Groups) और आवर्त (Periods) में की गई है। इस सारणी में 18 समूह और 7 आवर्त हैं। इसके अलावा, आधुनिक आवर्त सारणी को चार मुख्य ब्लॉक्स में विभाजित किया गया है:

इस प्रकार तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में प्रत्येक ब्लॉक के तत्वों के गुणधर्मों का अध्ययन किया जा सकता है, जो हमें रासायनिक गुणों को समझने में मदद करता है।
क्या आप Kinetic Energy Operator के बारे में जानना चाहते हैं? इसके बारे में सब कुछ समझने के लिए हमारी पूरी जानकारी पढ़ें, क्लिक करें और खुद को अपडेट करें!
आधुनिक आवर्त सारणी की विशेषताएँ
आवर्त सारणी की विशेषताएँ (Characteristics of the Periodic Table)
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अंतर्गत आवर्त सारणी की विशेषताओं का अध्ययन महत्वपूर्ण है। आवर्त सारणी का विभाजन समूहों और आवर्तों में किया गया है, जो तत्वों के गुणधर्मों को समझने और उनके मध्य संबंधों को जानने में मददगार है।
समूह (Groups)
समूह आवर्त सारणी में लंबवत (vertical) कॉलम होते हैं, जिनमें एक ही समूह में स्थित तत्वों के गुणधर्म मिलते-जुलते होते हैं। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अनुसार, वर्तमान आवर्त सारणी में 18 समूह हैं। उदाहरण के लिए:

समूहों का यह विभाजन, जैसा कि तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में वर्णित है, तत्वों के रासायनिक व्यवहार को समझने के लिए आवश्यक है क्योंकि प्रत्येक समूह में स्थित तत्वों का इलेक्ट्रॉनिक विन्यास समान होता है, जिससे उनके गुणधर्म भी मिलते-जुलते हैं।
आवर्त (Periods)
आवर्त सारणी में क्षैतिज (horizontal) पंक्तियाँ होती हैं, जिन्हें आवर्त कहा जाता है। प्रत्येक आवर्त में तत्व परमाणु क्रमांक के अनुसार व्यवस्थित होते हैं। आवर्त की विशेषताएं इस प्रकार हैं:
आवर्तों का क्रमिक परमाणु क्रमांक पर आधारित यह विभाजन, जैसा कि तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में बताया गया है, तत्वों के इलेक्ट्रॉनिक कॉन्फ़िगरेशन को दर्शाता है, जो उनके भौतिक और रासायनिक गुणों को प्रभावित करता है।

आवर्त सारणी में ब्लॉक्स का विभाजन
आधुनिक आवर्त सारणी को s, p, d, और f ब्लॉक्स में विभाजित किया गया है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में इन ब्लॉक्स का विवरण है, जो तत्वों के इलेक्ट्रॉनिक संरचना के आधार पर किया गया है:
आवर्त सारणी में तत्वों की प्रवृत्तियाँ (Trends in the Periodic Table)
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अंतर्गत आवर्त सारणी में तत्वों की प्रवृत्तियों का अध्ययन महत्वपूर्ण है, क्योंकि यह तत्वों के गुणधर्मों के बारे में जानकारी प्रदान करता है। विभिन्न प्रवृत्तियों के कारण ही तत्वों के बीच रासायनिक प्रतिक्रियाओं और भौतिक गुणों में बदलाव देखा जा सकता है।
1. परमाणु आकार (Atomic Size)
परमाणु आकार वह माप है जो परमाणु के नाभिक और बाहरीतम इलेक्ट्रॉन के बीच की दूरी को दर्शाता है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में परमाणु आकार की प्रवृत्तियाँ इस प्रकार हैं:

2. आयनन ऊर्जा (Ionization Energy)
आयनन ऊर्जा वह न्यूनतम ऊर्जा होती है, जो किसी गैसीय अवस्था वाले परमाणु से एक इलेक्ट्रॉन को हटाने के लिए आवश्यक होती है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अनुसार, आयनन ऊर्जा की प्रवृत्तियाँ इस प्रकार हैं:
3. विद्युत ऋणात्मकता (Electronegativity)
विद्युत ऋणात्मकता किसी परमाणु की वह प्रवृत्ति है जिससे वह रासायनिक बंध में साझा किए गए इलेक्ट्रॉनों को अपनी ओर आकर्षित करता है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अनुसार, विद्युत ऋणात्मकता की प्रवृत्तियाँ इस प्रकार हैं:

आधुनिक आवर्त सारणी का महत्व (Importance of Modern Periodic Table)
आधुनिक आवर्त सारणी विज्ञान में एक अत्यंत महत्वपूर्ण साधन है, जो तत्वों के गुणधर्मों और उनके आपसी संबंधों को समझने में सहायक है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अध्ययन से न केवल तत्वों के संगठन को समझने में मदद मिलती है, बल्कि यह रसायन शास्त्र की मूलभूत समझ को भी मजबूत करता है। इस सारणी के कई महत्वपूर्ण पहलू हैं जो छात्रों और वैज्ञानिकों दोनों के लिए उपयोगी हैं:
- तत्वों का वर्गीकरण (Classification of Elements)
आधुनिक आवर्त सारणी तत्वों को उनके परमाणु क्रमांक के आधार पर व्यवस्थित करती है, जिससे विभिन्न तत्वों को उनकी रासायनिक और भौतिक गुणों के अनुसार आसानी से समझा जा सकता है। यह तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में एक महत्वपूर्ण भाग है, जो छात्रों को तत्वों के बीच के संबंध को गहराई से समझने का अवसर देता है। - गुणधर्मों की भविष्यवाणी (Prediction of Properties)
इस सारणी के माध्यम से अज्ञात तत्वों के गुणधर्मों की भविष्यवाणी करना सरल हो जाता है। उदाहरण के लिए, मेंडलीव की आवर्त सारणी में जो गैप्स छोड़े गए थे, उनमें नए तत्वों की खोज की गई, जिनके गुणधर्म सारणी में उनके स्थान के आधार पर पहले से अनुमानित थे। यह तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के जरिए रसायन शास्त्र की शिक्षा को और भी सशक्त बनाता है। - रासायनिक प्रतिक्रियाओं की समझ (Understanding Chemical Reactions)
आधुनिक आवर्त सारणी के माध्यम से यह समझना आसान हो जाता है कि विभिन्न तत्व किस प्रकार की रासायनिक प्रतिक्रियाओं में भाग लेंगे। इस श्रेणीकरण से तत्वों के संयोजकता, आयनिकता, और अन्य गुणधर्मों का ज्ञान भी मिलता है, जो तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में शामिल अध्ययन का अहम हिस्सा है। - तत्वों की खोज में सहायक (Aid in Discovery of Elements)
आवर्त सारणी वैज्ञानिकों को नए तत्वों की खोज के लिए एक स्पष्ट मार्गदर्शन प्रदान करती है। इसे पढ़ने से विज्ञान के छात्रों को भी नए तत्वों की खोज और समझ में रुचि पैदा होती है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के माध्यम से इस प्रवृत्ति को विद्यार्थियों के स्तर पर भी प्रोत्साहित किया जा सकता है। - रासायनिक यौगिकों का अध्ययन (Study of Chemical Compounds)
आधुनिक आवर्त सारणी यह समझने में मदद करती है कि विभिन्न तत्वों के संयोजन से यौगिक कैसे बनते हैं। सारणी में तत्वों की स्थानिक व्यवस्था के आधार पर छात्रों को यह अनुमान लगाने में आसानी होती है कि कौन से तत्व आपस में मिलकर यौगिक बना सकते हैं। यह तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) का एक महत्वपूर्ण हिस्सा है, जो छात्रों को रासायनिक यौगिकों की संरचना और गुणधर्मों का ज्ञान प्रदान करता है। - शिक्षा में भूमिका (Role in Education)
छात्रों के लिए आधुनिक आवर्त सारणी एक बुनियादी उपकरण है जो रसायन शास्त्र की नींव को समझने में सहायक है। यह तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में एक मुख्य भूमिका निभाती है और भविष्य में रसायन शास्त्र के उन्नत अध्ययन के लिए एक सशक्त आधार प्रदान करती है।

रासायनिक गुणधर्म और आवर्त सारणी का संबंध (Relation Between Chemical Properties and Periodic Table)
आधुनिक आवर्त सारणी तत्वों के रासायनिक गुणधर्मों को व्यवस्थित रूप से समझने में अत्यधिक सहायक है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में इस संबंध का अध्ययन करना छात्रों के लिए जरूरी है, क्योंकि यह उनके रसायन शास्त्र के ज्ञान को विस्तार देता है। यह संबंध विशेष रूप से समूह (Groups) और आवर्त (Periods) में मौजूद तत्वों के गुणधर्मों से प्रकट होता है।
- समूहों में समान रासायनिक गुणधर्म (Similar Chemical Properties in Groups)
आवर्त सारणी के किसी भी समूह में आने वाले तत्वों में रासायनिक गुणधर्म लगभग समान होते हैं। उदाहरण के लिए, समूह 1 के क्षारीय धातुएं जैसे सोडियम (Na) और पोटैशियम (K) पानी के साथ तीव्रता से प्रतिक्रिया करते हैं और हाइड्रोजन गैस उत्पन्न करते हैं। इसी तरह, समूह 17 के हैलोजन जैसे क्लोरीन (Cl) और ब्रोमीन (Br) समान प्रकार की प्रतिक्रियाएं करते हैं। यह गुणधर्मों की समानता छात्रों के लिए तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) को अधिक संगठित रूप में समझने का अवसर देती है। - आवर्तों में रासायनिक गुणधर्मों का क्रमिक परिवर्तन (Gradual Change in Chemical Properties Across Periods)
किसी आवर्त में बाईं से दाईं ओर जाने पर तत्वों के गुणधर्मों में महत्वपूर्ण परिवर्तन देखने को मिलता है। उदाहरण के लिए, पहले आवर्त में सोडियम (Na) एक धातु है, जबकि उसी आवर्त में दाईं ओर स्थित क्लोरीन (Cl) एक अधातु है। आवर्त में यह धात्विक से अधात्विक गुणों में क्रमिक परिवर्तन तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) का एक महत्वपूर्ण पहलू है, जो छात्रों को तत्वों के विविध गुणों को समझने में मदद करता है। - धात्विक और अधात्विक गुणधर्मों का प्रवृत्तिगत परिवर्तन (Trends in Metallic and Non-Metallic Properties)
आवर्त सारणी में समूहों में नीचे की ओर जाने पर धात्विक गुण बढ़ते हैं, जबकि आवर्तों में बाईं से दाईं ओर धात्विक गुण घटते हैं और अधात्विक गुण बढ़ते हैं। उदाहरण के लिए, समूह 1 में लिथियम (Li) से फ्रैंसियम (Fr) की ओर जाने पर धात्विक गुण बढ़ते हैं। आवर्त में बाईं से दाईं ओर बढ़ने पर तत्वों में अधात्विक गुण बढ़ने लगते हैं। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के माध्यम से इस प्रवृत्ति का अध्ययन छात्रों के लिए रासायनिक प्रतिक्रियाओं की गहरी समझ विकसित करता है। - आयनन ऊर्जा का प्रभाव (Effect of Ionization Energy)
आयनन ऊर्जा वह ऊर्जा होती है जो एक परमाणु से इलेक्ट्रॉन निकालने में आवश्यक होती है। आवर्त में बाईं से दाईं ओर जाने पर आयनन ऊर्जा बढ़ती है और समूह में नीचे की ओर जाने पर यह घटती है। इससे यह पता चलता है कि समूहों में नीचे स्थित तत्व अधिक रासायनिक क्रियाशील होते हैं। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में यह आयनन ऊर्जा का पैटर्न समझना छात्रों को तत्वों के गुणधर्मों को सरलता से समझने में मदद करता है। - विद्युत ऋणात्मकता का प्रभाव (Effect of Electronegativity)
विद्युत ऋणात्मकता एक परमाणु की प्रवृत्ति होती है जिससे वह बंध में इलेक्ट्रॉनों को अपनी ओर आकर्षित करता है। आवर्त में बाईं से दाईं ओर जाने पर विद्युत ऋणात्मकता बढ़ती है, जबकि समूह में नीचे की ओर यह घटती है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के पाठ्यक्रम में यह प्रवृत्ति महत्वपूर्ण है क्योंकि इससे तत्वों के संयोजी गुण और बंध बनाने की क्षमता का ज्ञान प्राप्त होता है।

आवर्त सारणी के अध्ययन के लाभ (Advantages of Studying the Periodic Table)
आवर्त सारणी के अध्ययन से छात्रों, शिक्षकों, और शोधकर्ताओं को रसायन शास्त्र की गहराई को समझने में कई लाभ प्राप्त होते हैं। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के पाठ्यक्रम में यह अध्ययन छात्रों को रासायनिक तत्वों और उनकी प्रकृति को समझने के अवसर प्रदान करता है, जिससे वे रासायनिक गुणधर्मों को गहराई से जान पाते हैं।
- तत्वों के गुणधर्मों का ज्ञान (Understanding Properties of Elements)
आवर्त सारणी में तत्वों का संगठन उन्हें उनके गुणधर्मों के आधार पर समझना आसान बनाता है। उदाहरण के लिए, क्षार धातुएं और हलोजन जैसे तत्वों के गुणधर्म उनके समूह के आधार पर जानने में सरल होते हैं। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के माध्यम से छात्रों को तत्वों के भौतिक और रासायनिक गुणों का विस्तृत ज्ञान मिलता है, जो उनकी रसायन शास्त्र की नींव को मजबूत बनाता है। - रासायनिक प्रतिक्रियाओं का पूर्वानुमान (Predicting Chemical Reactions)
आवर्त सारणी के ज्ञान से छात्रों को यह समझने में मदद मिलती है कि विभिन्न तत्व एक-दूसरे के साथ किस प्रकार प्रतिक्रिया करते हैं। उदाहरण के लिए, हलोजन समूह के तत्व धातुओं के साथ मिलकर लवण बनाते हैं। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अंतर्गत यह ज्ञान छात्रों को रासायनिक बंधों और प्रतिक्रियाओं को भविष्यवाणी करने की क्षमता प्रदान करता है। - तत्वों का संगठनात्मक ज्ञान (Organizational Knowledge of Elements)
आवर्त सारणी तत्वों को व्यवस्थित करती है, जिससे उनके समूह, आवर्त, और ब्लॉक जैसे वर्गीकरण समझने में आसानी होती है। इससे तत्वों का अध्ययन सरल और अधिक संरचित हो जाता है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में यह संगठनात्मक ज्ञान छात्रों को तत्वों की प्रवृत्तियों को समझने में सहायक सिद्ध होता है, जिससे वे अपनी समझ को अधिक विस्तृत कर सकते हैं। - नए तत्वों की खोज में सहायता (Assistance in Discovering New Elements)
आवर्त सारणी के अध्ययन से वैज्ञानिकों को तत्वों की खोज में भी सहायता मिली है। तत्वों की कुछ स्थानों पर पूर्वानुमानित गुणधर्मों का पता होने से वैज्ञानिकों को नए तत्वों को खोजने में आसानी हुई है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के माध्यम से छात्र भी यह समझ सकते हैं कि कैसे भविष्य में नए तत्वों की खोज की जा सकती है। - रासायनिक अनुसंधान में सहायक (Support in Chemical Research)
आवर्त सारणी का अध्ययन रासायनिक अनुसंधान में एक मार्गदर्शक का कार्य करता है। शोधकर्ताओं को तत्वों के गुणधर्मों और प्रवृत्तियों का ज्ञान होने से वे नए यौगिकों और सामग्रियों का निर्माण कर पाते हैं। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अंतर्गत यह अध्ययन छात्रों को भी अनुसंधान और प्रयोग में रसायन शास्त्र को व्यावहारिक रूप से लागू करने के लिए प्रेरित करता है। - उद्योगों में उपयोगिता (Utility in Industries)
आवर्त सारणी का ज्ञान रासायनिक उद्योगों, औषधि निर्माण, और धातु विज्ञान जैसे क्षेत्रों में अत्यंत उपयोगी है। तत्वों की विशेषताओं को जानकर उद्योगों में उनकी सही उपयोगिता सुनिश्चित की जाती है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के माध्यम से इस जानकारी को प्राप्त करके छात्र आगे के औद्योगिक कार्यों और अनुसंधान में भी अपनी भूमिका निभा सकते हैं।

ग्राफिक विवरण (Visual Diagrams)
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अध्ययन में ग्राफिक विवरण महत्वपूर्ण भूमिका निभाते हैं, क्योंकि ये तत्वों की प्रवृत्तियों और उनके गुणधर्मों को स्पष्ट रूप से प्रदर्शित करते हैं। ग्राफिक और चार्ट का उपयोग करके, छात्र आवर्त सारणी में विभिन्न तत्वों के बीच संबंधों को समझ सकते हैं और उनकी विशिष्टताओं को जल्दी से पहचान सकते हैं।
1. आवर्त सारणी का ग्राफिक:
आवर्त सारणी का ग्राफिक चित्रण छात्रों को यह समझने में मदद करता है कि तत्वों को उनके परमाणु क्रमांक के अनुसार कैसे व्यवस्थित किया गया है। इसमें विभिन्न समूह और आवर्त को स्पष्ट रूप से दिखाया गया है, जिससे छात्र यह देख सकते हैं कि कैसे समान गुणधर्म वाले तत्व एक ही समूह में स्थित हैं।
2. तत्वों की प्रवृत्तियों के चार्ट:

इन ग्राफिक विवरणों का उपयोग तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अध्ययन में छात्रों के लिए एक अद्भुत उपकरण के रूप में किया जा सकता है। ये न केवल जानकारी को दृश्य रूप में प्रस्तुत करते हैं, बल्कि छात्रों की रचनात्मकता को भी प्रोत्साहित करते हैं, जिससे वे अवधारणाओं को बेहतर तरीके से समझ सकते हैं।
ग्राफिक और चार्ट के माध्यम से अध्ययन करने से छात्रों को तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अंतर्गत तत्वों के बीच संबंध और उनके गुणधर्मों को प्रभावी ढंग से समझने में मदद मिलती है, जिससे उनका ज्ञान और अधिक विस्तृत और गहरा हो जाता है।
FAQ Of तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10)
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) क्या है?
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में तत्वों को उनके गुणों, परमाणु संख्या, और आवर्तता के आधार पर समूहबद्ध किया गया है। इससे हमें तत्वों के गुण और उनकी रासायनिक प्रतिक्रिया को समझने में मदद मिलती है।
आवर्त सारणी (Periodic Table) क्या है और तत्वों का आवर्त वर्गीकरण कक्षा 10 में इसका महत्व क्या है?
आवर्त सारणी (Periodic Table) एक तालिका है, जिसमें तत्वों को उनके परमाणु संख्या के अनुसार व्यवस्थित किया गया है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में यह छात्रों को तत्वों की संगठन प्रणाली को समझने में मदद करता है।
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में तत्वों का क्रम कैसे तय होता है?
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में तत्वों को उनकी परमाणु संख्या के आधार पर व्यवस्थित किया गया है। जैसे-जैसे परमाणु संख्या बढ़ती है, तत्वों के गुण और उनके स्थान बदलते हैं।
आवर्त (Period) क्या होता है और इसका तत्वों का आवर्त वर्गीकरण कक्षा 10 में क्या महत्व है?
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अनुसार, आवर्त सारणी की पंक्तियों को “आवर्त” कहते हैं। प्रत्येक आवर्त में तत्वों के गुण क्रमशः बदलते हैं, जिससे हमें उनकी संरचना और विशेषताओं को समझने में मदद मिलती है।
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में कितने समूह होते हैं?
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में कुल 18 समूह होते हैं। प्रत्येक समूह में समान गुण वाले तत्व शामिल होते हैं।
आवर्त वर्गीकरण से तत्वों के गुण कैसे समझे जा सकते हैं?
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में तत्वों को ऐसे क्रम में रखा गया है कि समान गुण वाले तत्व एक ही समूह में आते हैं, जिससे उनकी भौतिक और रासायनिक विशेषताओं को समझना आसान हो जाता है।
आधुनिक आवर्त नियम (Modern Periodic Law) क्या है?
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अनुसार, आधुनिक आवर्त नियम के तहत तत्वों को उनकी परमाणु संख्या के अनुसार व्यवस्थित किया गया है, जिससे उनके गुणों का नियमित परिवर्तन देखने को मिलता है।
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में धातु, अधातु, और उपधातु कैसे वर्गीकृत होते हैं?
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में, धातु, अधातु, और उपधातु तत्वों के भौतिक और रासायनिक गुणों के अनुसार वर्गीकृत किए जाते हैं। धातु अच्छे संवाहक होते हैं, अधातु खराब संवाहक होते हैं, और उपधातु के गुण दोनों के बीच होते हैं।
आवर्त सारणी में ब्लॉक्स (Blocks) का क्या महत्व है?
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में ब्लॉक्स जैसे s-ब्लॉक, p-ब्लॉक, d-ब्लॉक और f-ब्लॉक के आधार पर तत्वों को वर्गीकृत किया गया है। यह ब्लॉक्स तत्वों के इलेक्ट्रॉनिक विन्यास और उनके रासायनिक गुणों को दर्शाते हैं।
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) में आवर्तता क्या है?
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अनुसार, आवर्तता तत्वों के गुणों का एक निश्चित अंतराल के बाद दोहराव है। यह आवर्त सारणी के प्रत्येक आवर्त में देखा जा सकता है, जिससे तत्वों के गुणों को अनुमानित किया जा सकता है।
उपसंहार (Conclusion) Of तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10)
आवर्त सारणी के विकास ने रसायन शास्त्र में तत्वों के अध्ययन और उनकी विशेषताओं को समझने के तरीके में क्रांतिकारी बदलाव लाए हैं। यह प्रणाली न केवल तत्वों के गुणधर्मों की व्यवस्थित जानकारी देती है, बल्कि वैज्ञानिकों और छात्रों के लिए अध्ययन को सरल और सुलभ बनाती है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) का पाठ्यक्रम छात्रों के लिए इस ज्ञान का एक मूल आधार है, जो उन्हें रसायन शास्त्र की जटिलताओं को समझने और सरलता से सीखने में सहायक सिद्ध होता है।
तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) से छात्रों को आवर्त सारणी में मौजूद विभिन्न प्रवृत्तियों, जैसे आयनन ऊर्जा, परमाणु आकार, और विद्युत ऋणात्मकता जैसी अवधारणाओं का गहन ज्ञान मिलता है। यह उन्हें यह समझने में मदद करता है कि तत्व किस प्रकार रासायनिक बंधों में जुड़ते हैं और विभिन्न रासायनिक प्रतिक्रियाओं में भाग लेते हैं।
इस सारणी ने वैज्ञानिक अनुसंधान में भी अनगिनत संभावनाएं उत्पन्न की हैं, जैसे नए तत्वों की खोज और यौगिकों के निर्माण में। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) के अध्ययन के माध्यम से, छात्रों को न केवल मूलभूत अवधारणाओं का ज्ञान प्राप्त होता है, बल्कि वे भविष्य में विज्ञान और अनुसंधान के क्षेत्र में योगदान करने के लिए भी तैयार होते हैं।
आवर्त सारणी का महत्व रसायन शास्त्र में स्थाई रूप से बना हुआ है। तत्वों का आवर्त वर्गीकरण कक्षा 10 (Periodic Classification of Elements Class 10) से संबंधित विषयों का अध्ययन छात्रों के लिए उनके शैक्षणिक विकास का एक अहम हिस्सा है। यह अध्ययन उन्हें वैज्ञानिक सोच, तत्वों की प्रवृत्तियों को समझने और अनुसंधान में नई खोजों के लिए प्रेरित करता है, जिससे उनका रसायन शास्त्र का आधार और मजबूत होता है।




